Request Demo
Last update 03 Jun 2025
Ebrasodebart
Last update 03 Jun 2025
Overview
Basic Info
Drug Type Monoclonal antibody |
Synonyms IGFBP3/TMEM219 inhibitor(Enthera), ENT 001, ENT-001 + [1] |
Target |
Action inhibitors |
Mechanism IGFBP3 inhibitors(Insulin-like growth factor binding protein III inhibitors), TMEM219 inhibitors(transmembrane protein 219 inhibitors) |
Active Indication |
Inactive Indication- |
Originator Organization |
Active Organization |
Inactive Organization- |
License Organization- |
Drug Highest PhasePhase 1 |
First Approval Date- |
Regulation- |
Login to view timeline
Structure/Sequence
Sequence Code 682557099L

Source: *****
Sequence Code 719970040H

Source: *****
Related
2
Clinical Trials associated with EbrasodebartCTIS2023-507340-36-00
- Ent001-CL-102
Start Date22 Apr 2024 |
Sponsor / Collaborator- |
NL-OMON51546
A phase 1, randomised, double-blind, placebo-controlled, single ascending dose study to evaluate the safety, tolerability, pharmacokinetics, pharmacodynamics and immunogenicity of Ent001 in healthy subjects - Ent001 IV First in Human SAD Study in adult healthy subjects
Start Date09 Jan 2023 |
Sponsor / Collaborator- |
100 Clinical Results associated with Ebrasodebart
Login to view more data
100 Translational Medicine associated with Ebrasodebart
Login to view more data
100 Patents (Medical) associated with Ebrasodebart
Login to view more data
9
News (Medical) associated with Ebrasodebart28 May 2025
Preclinical data demonstrate crucial role of Transmembrane Protein 219 (TMEM219) in exacerbating inflammatory bowel disease (IBD) by inducing intestinal epithelial stem cell (ISC) death and impairing mucosal healing Findings support Phase 1 clinical development of Enthera’s lead candidate, Ebrasodebart (Ent001), a monoclonal antibody targeting the IGFBP3/TMEM219 pathway Ebrasodebart is currently being studied in a proof-of-concept Phase 1b clinical trial for the treatment of ulcerative colitis (UC)
Milan, Italy, May 28, 2025 – Enthera Pharmaceuticals (“Enthera”), a clinical-stage biotech company developing a first-in-class antibody therapeutic targeting the Insulin Growth Factor Binding Protein 3 (IGFBP3)/TMEM219 pathway for IBD and T1D, today announced the publication of preclinical data in The Journal of Clinical Investigation that revealed TMEM219’s key role in driving ISC apoptosis and impairing mucosal healing in IBD.
The findings support Enthera’s clinical development of Ebrasodebart, a monoclonal antibody that targets the IGFBP3/TMEM219 pathway for the treatment of IBD, including UC and Crohn’s disease. The company recently completed patient enrollment in the Phase 1b trial with Ebrasodebart in patients with UC.
“Our publication in the prestigious Journal of Clinical Investigation is a validation of our scientific approach and testament to our team’s commitment to targeting the TMEM219 pathway in IBD,” said Dr. Lisa M. Olson, CEO of Enthera. “This research sheds light on the complex pathophysiology of IBD and supports the examination of the potential of Ebrasodebart to deliver clinical benefit to those patients who do not respond to existing immunomodulating treatments.”
As outlined in the publication, patients with refractory or active Crohn’s disease experienced overactive TMEM219 signaling that correlated with a failure to regenerate the mucosal layer, despite immune suppressive therapy, and contributed to increased ISC death. Regulating TMEM219 by blocking the interaction between the protein and its ligand, IGFBP3, restored the self-renewal capabilities in vitro in patient-derived organoids (PDOs). These results were further supported by the demonstration of attenuating TMEM219 in vivo, which improved colitis symptoms and promoted mucosal healing in mouse models. The preclinical findings suggest the potential of a new therapeutic avenue focused on epithelial repair.
About Enthera Pharmaceuticals
Enthera Srl is a clinical-stage biotech company developing first-in-class antibody therapeutics to transform the treatment paradigm in inflammatory bowel diseases (IBD) and type 1 diabetes (T1D) by re-establishing stem cell capabilities. Enthera’s pioneering approach capitalizes on the key discovery of the IGFBP3/TMEM219 pathway, which is dysregulated in IBD and T1D patients and leads to excessive apoptosis of stem cell in the gut and beta cells in the pancreas. Enthera’s lead program, Ebrasodebart (Ent001), which is currently in Phase 1 clinical development, has the potential to restore the original intestinal mucosal structure in IBD and the endogenous pancreatic stem cell compartment in T1D, resulting in the restoration of organ function.
Enthera is a private company headquartered in Milan, Italy and founded in 2016 by Prof. Paolo Fiorina and Dr. Francesca D’Addio with BiovelocITA, Italy’s first biotech accelerator. Enthera’s discovery engine and assets are protected by a broad portfolio of patents. The company is backed by Sofinnova Partners, AbbVie Ventures, T1D Fund, Roche Venture Fund, and several Italian private investors.
For further information: www.entherapharmaceuticals.com
Enthera Pharmaceuticals Lisa M. Olson Ph.D., CEO info@entherapharmaceuticals.com
Trophic Communications Valeria Fisher or Veronika Máté +49 175 8041816 or +49 160 90816161 enthera@trophic.eu
Download this Press Release in PDF (250 KB)
I dati preclinici dimostrano il ruolo cruciale della proteina transmembrana 219 (TMEM219) nell’esacerbare la malattia infiammatoria intestinale (IBD) inducendo la morte delle cellule staminali epiteliali intestinali (ISC) e compromettendo la guarigione della mucosa I risultati supportano lo sviluppo clinico di Fase 1 del candidato principale di Enthera, Ebrasodebart (Ent001), un anticorpo monoclonale che ha come bersaglio l’asse IGFBP3/TMEM219 Ebrasodebart è attualmente in fase clinica con uno studio ‘proof-of-concept’ di fase 1b nei pazienti con rettocolite ulcerosa (UC)
Milano, Italia, 28 maggio 2024 – Enthera Pharmaceuticals (“Enthera”) – una società biotech che sviluppa farmaci biologici “first in class” con meccanismo d’azione innovativo per le malattie infiammatorie nelle quali sono coinvolti i mediatori della famiglia delle proteine IGFBP (IGF-binding proteins) – annuncia oggi la pubblicazione di dati preclinici su The Journal of Clinical Investigation che hanno rivelato il ruolo chiave di TMEM219 nell’indurre l’apoptosi delle ISC e quindi nel arrestare la rigenerazione della mucosa nelle malattie infiammatorie croniche intestinali (IBD).
I risultati supportano lo sviluppo clinico da parte di Enthera di Ebrasodebart, un anticorpo monoclonale che ha come bersaglio l’asse IGFBP3/TMEM219 per il trattamento delle IBD, tra cui l’UC e il morbo di Crohn. L’azienda ha recentemente completato l’arruolamento dei pazienti nello studio di Fase 1b con Ebrasodebart in pazienti affetti da UC.
“La pubblicazione sul prestigioso Journal of Clinical Investigation è la dimostrazione della validità scientifica del nostro approccio innovativo e testimonia l’impegno del nostro team nel puntare sull’asse del TMEM219 per il trattamento delle IBD”, ha dichiarato la dott.ssa Lisa M. Olson, CEO di Enthera. “Questa ricerca fa luce sulla complessa fisiopatologia delle IBD e supporta la valutazione del potenziale di Ebrasodebart nel fornire una cura a quei pazienti che non rispondono ai trattamenti immunomodulanti esistenti”.
Come illustrato nella pubblicazione, i pazienti con malattia di Crohn refrattaria o attiva presentano una iperattivazione di TMEM219 che è correlata alla mancata rigenerazione della mucosa, nonostante la terapia immunosoppressiva, e contribuisce a un aumento della morte delle ISC. La regolazione di TMEM219 mediante il blocco dell’interazione tra la proteina e il suo ligando, IGFBP3, ha ripristinato le capacità replicative in vitro negli organoidi derivati dai pazienti (PDO). Questi risultati sono stati ulteriormente supportati dalla dimostrazione dell’inibizione di TMEM219 in vivo, che ha migliorato i sintomi della colite e promosso la guarigione della mucosa nei modelli murini. I risultati preclinici suggeriscono il potenziale di una nuova via terapeutica incentrata sulla riparazione epiteliale.
Informazioni su Enthera Pharmaceuticals
Enthera Srl è un’azienda biotecnologica in fase clinica che sta sviluppando farmaci biologici “first in class” per trasformare il paradigma di trattamento delle malattie infiammatorie intestinali (IBD) e del diabete di tipo 1 (T1D), ristabilendo le capacità funzionali delle cellule staminali.
L’approccio pionieristico di Enthera si basa sulla scoperta del pathway IGFBP3/TMEM219, coinvolto nell’apoptosi delle cellule staminali e delle cellule beta rispettivamente nell’intestino e nel pancreas. Il programma principale di Enthera, Ent001, attualmente in Fase 1, ha il potenziale di ricostruire la struttura intestinale originale nelle IBD e il compartimento endogeno delle cellule staminali pancreatiche nella T1D, con conseguente ripristino della funzionalità dell’organo.
Enthera è un’azienda privata con sede a Milano, fondata nel 2016 dal Prof. Paolo Fiorina e dalla Dott.ssa Francesca d’Addio insieme a BiovelocITA, il primo acceleratore biotech italiano.
La ricerca e le scoperte di Enthera sono protette da un ampio portafoglio di brevetti.
L’azienda è sostenuta da Sofinnova Partners, AbbVie, T1D Fund, Roche e diversi investitori privati italiani capitanati da Arepo Fiduciaria e BANOR SIM.
Per ulteriori informazioni: www.entherapharmaceuticals.com
Enthera Pharmaceuticals Lisa M. Olson Ph.D., CEO info@entherapharmaceuticals.com
Trophic Communications Valeria Fisher or Veronika Máté +49 175 8041816 or +49 160 90816161 enthera@trophic.eu
Scarica il Comunicato Stampa in PDF (257 KB)
Phase 1Immunotherapy
20 Feb 2024
Enthera Pharmaceuticals (“Enthera”), a clinical-stage biotech company developing first-in-class antibody therapeutics targeting the Insulin Growth Factor Binding Protein (IGFBP) family for selected inflammatory diseases, confirms its attendance at the European Crohn´s and Colitis Organization – ECCO’24 (ecco-ibd.eu) Conference, scheduled to take place in Stockholm from February 21st to 24th.
Enthera will be presenting new preclinical data demonstrating mucosal healing of the GI tract following treatment with our first-in-class anti-TMEM219 monoclonal antibody, Ent001.
Enthera will be participating in the guided poster session on Friday, the 23rd of February, where our poster (P171) entitled “Rescuing Intestinal Stem Cells via TMEM219 inhibition promotes mucosal healing in Crohn’s disease” will be showcased.
“We are pleased to share the compelling preclinical data with Ent001 in the DSS colitis model that demonstrates significant mucosal healing with both prophylactic and therapeutic dosing regimens. Ent001 offers a potenfial new treatment option for inflammatory bowel disease and is currently being studied in a multiple ascending dose study in ulcerative colitis” said Lisa M. Olson, CEO.
About Enthera Pharmaceuticals Enthera Srl is a clinical-stage biotech company developing first-in-class antibody therapeutics to transform the treatment paradigm in inflammatory bowel diseases (IBD) and type 1 diabetes (T1D) by re-establishing stem cell capabilities. Enthera’s pioneering approach capitalizes on the key discovery of the IGFBP3/TMEM219 pathway, which is involved in stem cell and beta cell apoptosis in the gut and pancreas, respectively. Enthera’s lead program, Ent001, which is currently in Phase 1 clinical development, has the potential to restore the original intestinal mucosal structure in IBD and the endogenous pancreatic stem cell compartment in T1D, resulting in the restoration of organ function.
Enthera is a private company headquartered in Milan, Italy and founded in 2016 by Prof. Paolo Fiorina and Dr. Francesca D’Addio with BiovelocITA, Italy’s first biotech accelerator. Enthera’s discovery engine and assets are protected by a broad portfolio of patents. The company is backed by Sofinnova Partners, AbbVie Ventures, JDRF T1D Fund, Roche Venture Fund, and several private investors.
For further information: www.entherapharmaceuticals.com
Enthera Pharmaceuticals Lisa M. Olson Ph.D., CEO info@entherapharmaceuticals.com
Phase 1ADC
23 Jan 2024
Industry veteran Dr. Olson moves from Enthera’s Board to take the helm as CEO
Ent001 Phase 1a trial in healthy volunteers completed with positive topline safety results
Company has initiated enrollment for Ent001 Phase 1b trial in patients with moderately to severely active ulcerative colitis
MILAN--(BUSINESS WIRE)-- Enthera Pharmaceuticals (“Enthera”), a clinical-stage biotech company developing first-in-class antibody therapeutics targeting the Insulin Growth Factor Binding Protein (IGFBP) family for selected inflammatory diseases, today announced the appointment of Lisa M. Olson, Ph.D., as the company’s Chief Executive Officer. Dr. Olson joins Enthera’s management team with over two decades of leadership experience in the biopharmaceutical industry including a successful career at AbbVie. She previously served as a member of Enthera’s Board of Directors and Chair of the Scientific Advisory Board.
Enthera also announced completion of Ent001’s Phase 1a single-ascending dose trial in healthy volunteers, establishing a positive safety and tolerability pro enabling the start of the Phase 1b multiple ascending dose trial in ulcerative colitis (UC) patients. UC is a chronic gastrointestinal disease, and while treatment options using immune suppressors are efficacious, they still fail to provide a durable and long-term response for many patients with moderately to severely active disease. Ent001 is a monoclonal antibody targeting the IGFBP3/TMEM219 pathway, which plays a critical role in gut mucosal integrity and is dysregulated in patients with inflammatory bowel diseases (IBD), including UC.
“We are entering the new year with positive momentum in Enthera’s corporate and clinical evolution with Lisa’s appointment as CEO and important progress with Ent001. The Enthera team will benefit from Lisa’s scientific and R&D expertise and leadership experience cultivated across the pharmaceutical and biotechnology industries. We are thrilled to have her join as CEO,” said Silvano Spinelli, Chairman of the Enthera Board of Directors.
“I look forward to working with the Enthera team to further drive Ent001’s clinical development trajectory. We have defined an exciting opportunity with Ent001 for the long-term treatment of ulcerative colitis, a disease that continues to negatively impact the lives of many patients,” added Dr. Lisa M. Olson, CEO of Enthera. “My goal is to ensure we deliver on the potential of Ent001 in the clinic and to achieve our ambitious corporate objectives for 2024.”
Ent001 Clinical Development Updates
Enthera completed its single ascending dose (SAD) Phase 1a trial evaluating Ent001 in healthy volunteers, thereby laying the groundwork for evaluation in patients with IBD and other indications, including type 1 diabetes (T1D), where the IGFBP3/TMEM219 pathway also plays a key pathogenetic role. The Phase 1a trial was conducted in the Netherlands and involved 30 healthy volunteers who received single ascending doses of Ent001 or placebo administered by intravenous infusion. The trial results established a very positive safety and tolerability pro Ent001 without any observations of drug-related clinically relevant adverse reactions up to the highest dose tested (10mg/kg). The pharmacokinetics (PK) were linear, and the exposures reached in this study fully cover the concentrations that are predicted to be effective in patients, based on the maximum effective dose in animal disease models of UC.
Based on this, Enthera has initiated a multiple ascending dose (MAD) Phase 1b clinical trial in patients with moderately to severely active UC.
The Phase 1b multicenter, randomized, double-blind, placebo-controlled trial will evaluate the safety, tolerability, immunogenicity and PK of multiple ascending doses of Ent001 in up to 40 patients with moderately to severely active UC. The trial will also analyze pharmacodynamic responses by measuring peripheral and colon tissue biomarkers of IGFBP3/TMEM219 pathway inhibition to demonstrate proof of mechanism in patients with active colitis. Patients will be dosed up to week 12 to collect exploratory efficacy data and evidence of the compelling mucosal healing effect observed in preclinical models of colitis.
About Dr. Lisa M. Olson, CEO of Enthera
Prior to joining Enthera, Dr. Olson most recently served as the Chief Scientific Officer of Magenta Therapeutics where she was responsible for the strategic direction and execution of the company’s research and development efforts. Before this, Dr. Olson held various leadership positions at AbbVie and Abbott Laboratories for fifteen years, culminating in her role as Vice President Immunology Discovery and Site Head of the AbbVie Bioresearch Center. During her time at AbbVie she successfully advanced 15 molecules into clinical development including Rinvoq™ (upadacitinib) for the treatment of several conditions, including UC. Dr. Olson joined Abbott following her time as a Research Fellow in Inflammation and Immunology at Pfizer, Inc. Dr. Olson started her career as an Assistant Professor at Washington University School of Medicine following a post-doctoral cardiovascular fellowship at the University of Chicago. She holds a Ph.D. from the University of Illinois at Urbana-Champaign and a B.S. from Iowa State University.
About Enthera Pharmaceuticals
Enthera Srl is a clinical-stage biotech company developing first-in-class antibody therapeutics to transform the treatment paradigm in inflammatory bowel diseases (IBD) and type 1 diabetes (T1D) by re-establishing stem cell capabilities. Enthera’s pioneering approach capitalizes on the key discovery of the IGFBP3/TMEM219 pathway, which is involved in stem cell and beta cell apoptosis in the gut and pancreas, respectively. Enthera’s lead program, Ent001, which is currently in Phase 1 clinical development, has the potential to restore the original intestinal mucosal structure in IBD and the endogenous pancreatic stem cell compartment in T1D, resulting in the restoration of organ function.
Enthera is a private company headquartered in Milan, Italy and founded in 2016 by Prof. Paolo Fiorina and Dr. Francesca D’Addio with BiovelocITA, Italy’s first biotech accelerator. Enthera’s discovery engine and assets are protected by a broad portfolio of patents. The company is backed by Sofinnova Partners, AbbVie, JDRF T1D Fund, Roche Venture Fund, and several private investors.
For further information:
View source version on businesswire.com:
Contacts
Enthera Pharmaceuticals
Lisa M. Olson Ph.D., CEO
info@entherapharmaceuticals.com
Trophic Communications
Valeria Fisher or Veronika Máté
+49 175 8041816 or +49 160 90816161
enthera@trophic.eu
Source: Enthera Pharmaceuticals
View this news release online at:
Phase 1Executive ChangePhase 2
100 Deals associated with Ebrasodebart
Login to view more data
R&D Status
10 top R&D records. to view more data
Login
| Indication | Highest Phase | Country/Location | Organization | Date |
|---|---|---|---|---|
| Inflammatory Bowel Diseases | Phase 1 | Netherlands | 07 Mar 2023 | |
| Diabetes Mellitus, Type 1 | Phase 1 | Netherlands | 09 Jan 2023 | |
| Colitis, Ulcerative | Phase 1 | - | - | |
| Crohn Disease | Preclinical | Italy | 28 May 2025 |
Login to view more data
Clinical Result
Clinical Result
Indication
Phase
Evaluation
View All Results
| Study | Phase | Population | Analyzed Enrollment | Group | Results | Evaluation | Publication Date |
|---|
No Data | |||||||
Login to view more data
Translational Medicine
Boost your research with our translational medicine data.
login
or

Deal
Boost your decision using our deal data.
login
or

Core Patent
Boost your research with our Core Patent data.
login
or
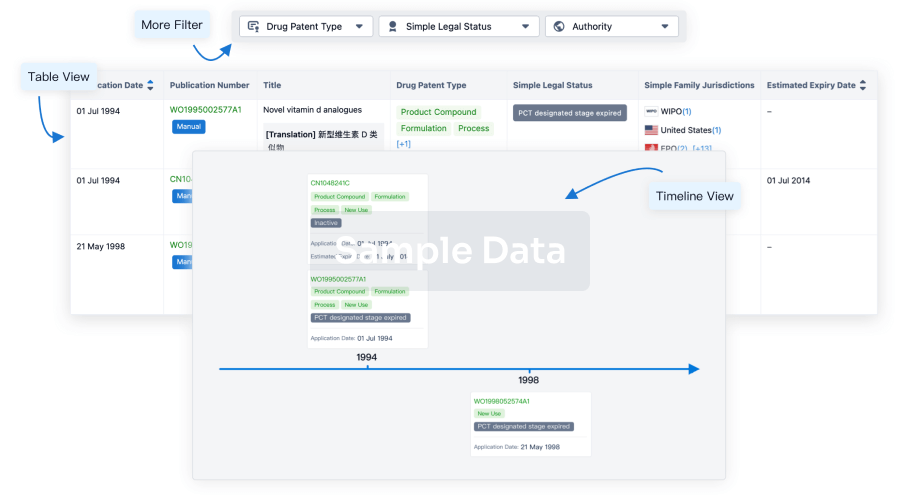
Clinical Trial
Identify the latest clinical trials across global registries.
login
or

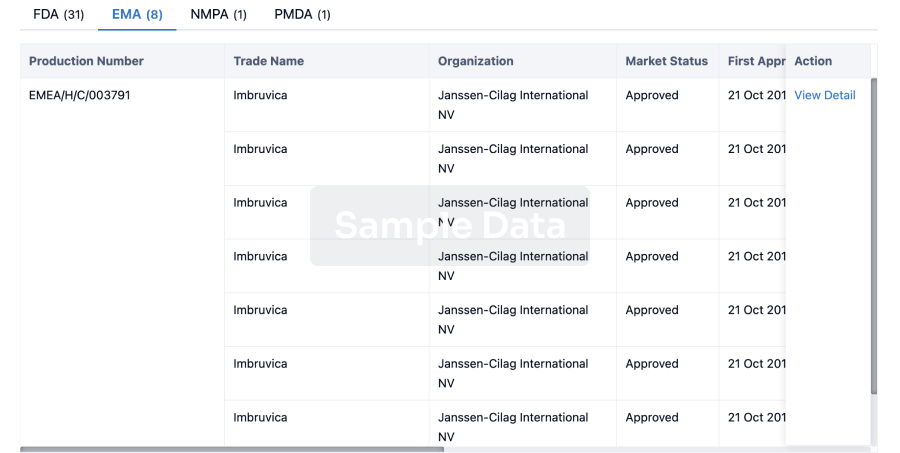
Approval
Accelerate your research with the latest regulatory approval information.
login
or
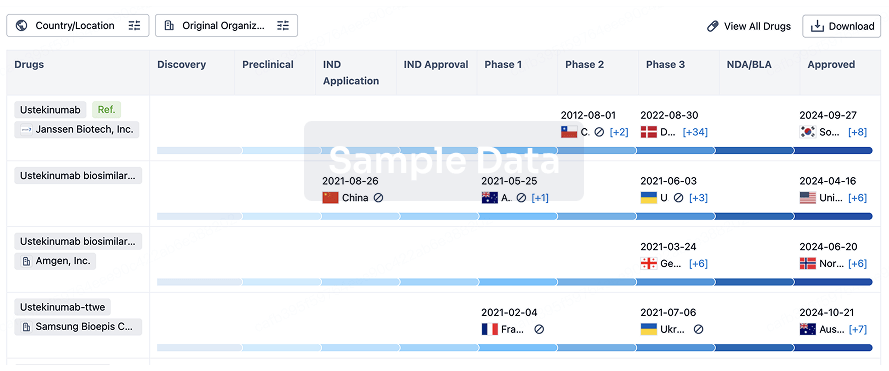
Biosimilar
Competitive landscape of biosimilars in different countries/locations. Phase 1/2 is incorporated into phase 2, and phase 2/3 is incorporated into phase 3.
login
or
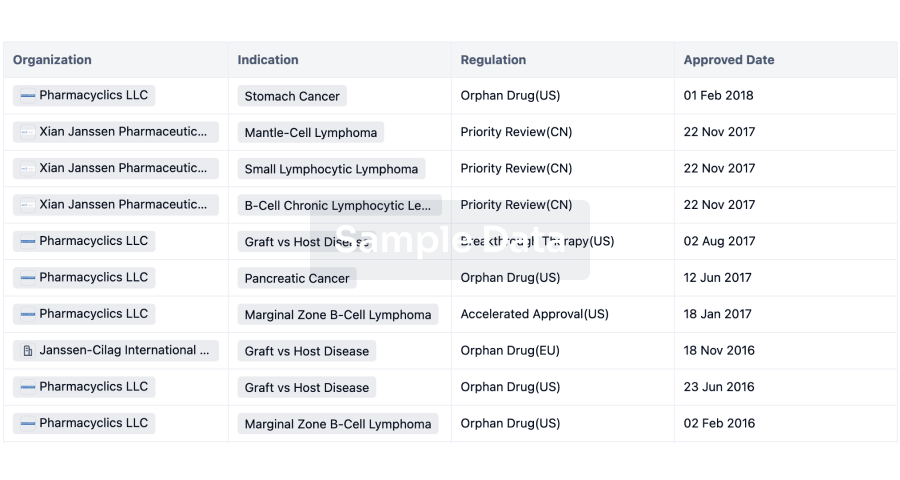
Regulation
Understand key drug designations in just a few clicks with Synapse.
login
or
AI Agents Built for Biopharma Breakthroughs
Accelerate discovery. Empower decisions. Transform outcomes.
Get started for free today!
Accelerate Strategic R&D decision making with Synapse, PatSnap’s AI-powered Connected Innovation Intelligence Platform Built for Life Sciences Professionals.
Start your data trial now!
Synapse data is also accessible to external entities via APIs or data packages. Empower better decisions with the latest in pharmaceutical intelligence.
Bio
Bio Sequences Search & Analysis
Sign up for free
Chemical
Chemical Structures Search & Analysis
Sign up for free
